中学1年生の化学分野まとめ
中学1年生の理科の学習は、一般的に生物、地学、化学と進んでいきます。生物、地学は大丈夫だったけど、なぜか化学ができないという、苦手意識を持つ生徒を見かけることがあります。生物、地学と同じように、暗記することがメインの学習ではありますが、化学はより知識の繋がりが重要になってきます。単純に語句を覚えるだけでは、多様な問題に対応することができないのです。

有機物と無機物
まずはじめに学習する重要語句が有機物と無機物です。有機物は炭素を含む物質で、それ以外を無機物と言います。しかしこれだけをおぼえるだけではいけません。具体的にどういう物質が有機物と無機物であるのかも知る必要があります。
例えば実際の問題では、物質を燃やす実験などを行い、その結果から有機物か無機物かを答えたりします。このとき、有機物の多くは炭素のほかに水素を含んでおり、燃やすと二酸化炭素を水が発生するという知識を知っている必要もあります。
| 有機物 | 無機物 |
|---|---|
| 砂糖、木、ろう、エタノール、プラスチック…など | 食塩、ガラス、水、鉄や銅などの金属…など |
いろいろな気体の性質
次に気体の性質です。まずは、以下の表を覚える必要があります。
| 酸素 | 二酸化炭素 | アンモニア | 水素 | 窒素 | |
|---|---|---|---|---|---|
| におい | なし | なし | 刺激臭 | なし | なし |
| 空気と比べた重さ | 少し重い | 重い | 軽い | 非常に軽い | 少し軽い |
| 水へのとけやすさ | とけにくい | 少しとける | 非常にとける | とけにくい | とけにくい |
| その他の性質 | ものを燃やすはたらきがある | 石灰水を白くにごらせる | 水溶液はアルカリ性 | 火をつけると音をたて燃える | 空気中の78%を占める気体 |
しかし、これを丸暗記するだけでなく、知識と知識を繋げることが大切です。例えば表の右下、窒素は空気中の約78%を占める気体とありますが、空気は他に酸素が約21%、二酸化炭素を含むその他の気体が1%で構成されています。そう考えると、表の2列目「空気と比べた重さ」で、酸素が空気より少し重く、窒素が空気より少し軽いことも納得がいくでしょう。また、言葉だけではわからないことは、実験で理解することも大切です。例えば酸素と水素は、燃やす・燃えるという性質がありますが、言葉だけではわかりにくいと思います。しかし実験では、「酸素の中に火がついた線香を入れると激しく燃える」という実験や、「水素の近くに火を近づけると、ポンと音を立てて燃える」という実験などで、具体的にその現象を認識することができます。知識と知識、知識と実験を結び付けていくと、理解は確実に深まります。
気体の集め方
気体の集め方は、水中で集める水上置換法、空気中の上向きに集める上方置換法、空気中の下向きに集める下方置換法、の3つです。では、どの気体がどの集め方なのかというのを、ただの丸暗記をしているようではいけません。まず、最優先の方法が水上置換法です。水中で気体を集めることで、他の気体と混ざることなく集めることができるからです。しかし、水上置換法で集められない気体があります。そう、水に溶けやすい気体です。これを理解するだけで、上記の表にある5つの気体のうち、二酸化炭素とアンモニア以外は、水上置換法で集められるとわかります。あとは空気より重い二酸化炭素下方置換法、軽いアンモニアは上方置換法で集めるわけです。ちなみに上の表にあるように、二酸化炭素は水に少し溶ける程度なので、水上置換法でも集めることができます。このように知識がつながれば、理解度は一気に高くなり、頭に定着しやすくなります。
密度
化学では計算問題が出てくることも、苦手な生徒がいる原因のひとつです。しかし、理解すれば難しいことはありません。まず密度ですが、簡単に言うと密度は、物質がどれくらい中身の詰まったものか、ということです。つまり、体積(物質の大きさ)に対して、質量(物質の量)がどれくらいなのか、ということを表しています。
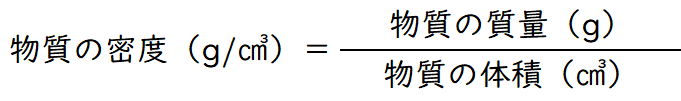
結局、密度は一定の決まった体積での質量を考えよう、というだけです。上の公式が密度の求め方ですが、難しく考える必要はありません。単純に、1㎤あたりの質量(g)を求める式なのです。小学生の算数「単位量あたりの大きさ」の考え方そのものです。
【例題】100㎤で500gの密度は? → 5g/㎤(1㎤で5g)
質量パーセント濃度
中学1年生の化学ではもう一つ、質量パーセント濃度の公式が出てきます。これも小学校で出てきた「割合」の考え方で十分理解できるはずです。例えば、100gの食塩水に20gの食塩が溶けていたら、溶けてている食塩は20%ですが、実は質量パーセント濃度も、これと全く同じです。
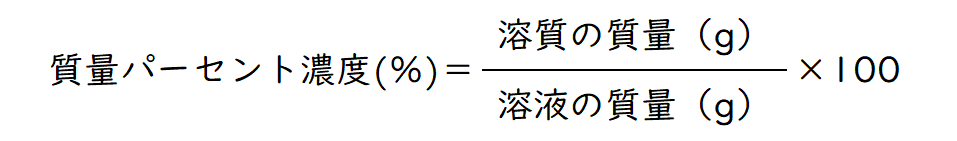
中学になると、解けている物質を溶質、溶かしている液体を溶媒、溶質+溶媒を溶液と言います(溶媒が水の場合は水溶液と言う)。今回の例では、食塩が溶質、水が溶媒、食塩水が溶液となります。上記の公式で質量パーセント濃度とは、溶液の中の溶質の割合(食塩水の中の食塩の割合)であり、パーセントで表すために、最後に100をかけているのです。
【例題】水200gに硝酸カリウム50gを溶かした水溶液の質量パーセント濃度は? → 20%(溶質50g÷溶液250g×100)
水溶液の溶解度
食塩水についてもう少し考えてみましょう。水に食塩を溶かしていくと、途中で食塩が溶けなくなってしまいます。このように、ある溶液が限度までとけている状態を飽和しているといい、その水溶液を飽和水溶液と言います。水に溶ける物質の質量は、物質の種類と温度によって決まっています。水100gに物質を溶かして飽和水溶液にしたとき、溶けた物質の質量を、その物質の溶解度と言います。溶解度と温度との関係は、溶解度曲線というグラフで表されます。溶解度曲線を用いた問題は、この範囲で頻出の内容なので、実際の問題を解いて確認しておきましょう。
物質の状態変化
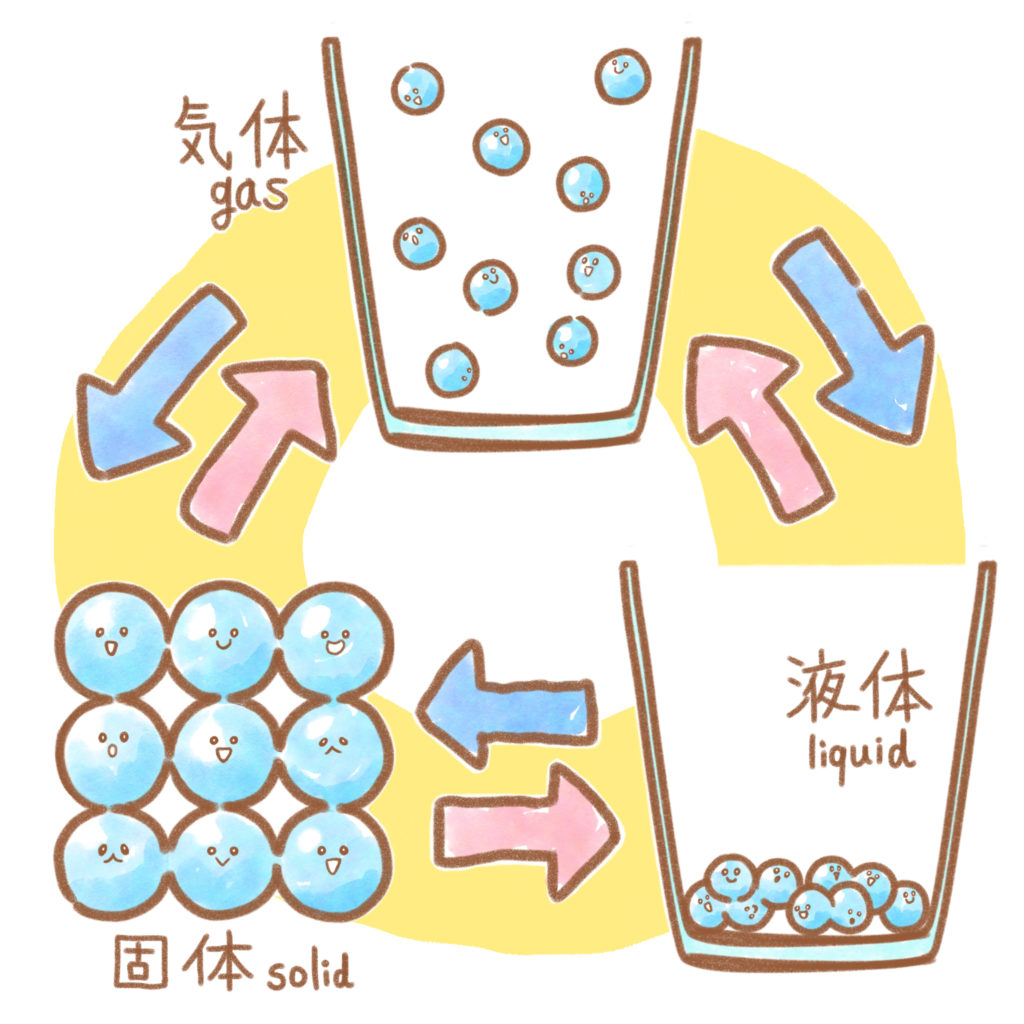
1年の化学の最後は状態変化についてです。物質は、加熱することで「個体→液体→気体」と状態が変わり、これを状態変化と言います。冷却すると、逆に「気体→液体→個体」と状態変化します。例えば水は「氷→水→水蒸気」と変化しますが、これは物質そのものや質量が変化するわけではなく、物質をつくる粒子の密度、物質の体積が変わるのです。
一般的に、個体は体積が小さく(密度が大きく)、気体は体積が大きい(密度が小さく)なります。体積が大きいと、物質の粒子は自由に動き回れるので形を変化しやすいですが、体積が小さいと物質の粒子が動けず固まった状態になります。水蒸気と氷を想像してもらえればお分かりになるかと思います。
また、個体がとけて液体に変化するときの温度を融点、液体が沸騰して気体に変化するときの温度を沸点と言います。融点も沸点も、物質によって温度が決まっています。
まとめ
中学1年生の化学では、大きく分けて、①いろいろな物質、②気体の性質、③水溶液の性質、④物質の状態変化の4つです。今回紹介した内容は、つまづきやすいところを中心に、全体的に説明していきましたが、もちろん全てを説明したわけではありません。この記事を読んで、概要をつかめたら、ぜひ学校の教科書を読んでみてください。教科書は学習内容を全て網羅して、わかりやすくまとめてくれています。教科書を読まない学生は、驚くほど多いのですが、教科書ほど勉強に最適な教材はありません。ぜひ繰り返しよんでみてください。そして繰り返しになりますが、1つ1つを暗記するだけでなく、覚えた知識を繋げて、問題を解けるようになってほしいと思います。